美国FDA批准诺华飞尼妥用于晚期乳腺癌治疗
美国德州大学MD安德森癌症中心乳腺癌治疗主席Gabriel Hortobagyi医学博士说:“飞尼妥是首个也是唯一可增强内分泌治疗效果的治疗药物,显著延长了晚期乳腺癌妇女的无进展生存时间。飞尼妥的获批重新定义了晚期激素受体阳性乳腺癌的治疗及管理,为医生和患者提供了一个重要的新选择。”
全球每年约有220,000名妇女被诊断为晚期激素受体HR阳性乳腺癌,这是乳腺癌最常见的类型。在美国,仅今年一年预计就有近40,000名新诊断的晚期乳腺癌患者。诊断时,约70%的侵袭性乳腺癌中HR表达呈阳性。
该批准基于一项随机化、双盲、安慰剂对照、多中心试验(BOLERO-2试验)、该试验评估了724名使用来曲唑或阿那曲唑治疗后发生疾病复发或进展的晚期激素受体阳性乳腺癌绝经后妇女。这项III期临床试验表明,基于独立中心放射学审查的分析显示飞尼妥+依西美坦使中位无疾病进展生存期(PFS)延长至11个月,而单用依西美坦仅延长了4.1个月。临床获益率与对照组相比,提高至2倍。最常见的不良反应为口腔炎、感染、皮疹、疲劳、腹泻和食欲减退。最常见的3-4 级不良反应为口腔炎、感染、高血糖、疲劳、呼吸困难,肺炎和腹泻。 “
飞尼妥治疗晚期乳腺癌的批准对于诺华来说都是非常值得骄傲的一件大事。我们为在与该疾病做斗争的患者和医生带来了一个全新的、高效的治疗方法,”诺华肿瘤全球总裁Hervé Hoppenot说,“该里程碑的实现是研究飞尼妥治疗晚期乳腺癌的全球研究者以及参加该试验的700多名患者共同努力的结果。”
由于内分泌治疗仍是这些妇女的基础疗法,绝大多数患者最终会出现耐药。治疗抵抗的发生与PI3K/AKT/mTOR 通路的过度激活有关。飞尼妥靶向作用于mTOR通路,该通路在多种类型的癌细胞中被过度激活。mTOR是一种蛋白质,是肿瘤细胞分裂、血管生成和细胞代谢的重要调节因子。
作为飞尼妥的第5个适应症,这是FDA首次批准mTOR抑制剂在美国用于治疗晚期HR阳性乳腺癌。两项正在进行的III期试验亦在HER2阳性乳腺癌中研究了飞尼妥的疗效。 晚期乳腺癌是指晚期激素受体阳性、HER2阴性乳腺癌(晚期HR阳性乳腺癌)包括转移性乳腺癌(IV期)和局部晚期乳腺癌(III 期)。转移性乳腺癌是最严重的疾病类型,其癌细胞扩散至身体的其他部分,如骨或肝脏。局部晚期乳腺癌为癌细胞扩散至乳腺区域的淋巴结和/或其他组织,但未扩散至身体的远处部位。
据估计,转移性乳腺癌妇女确诊后的预期寿命约为18-36个月,III期乳腺癌妇女的中位生存时间少于5年。
晚期HR阳性乳腺癌的特点为激素受体肿瘤,表达特定激素,例如雌激素和黄体酮受体的一组癌症。癌细胞生长受这些激素的驱动。雌激素受体(ER)和/或黄体酮(PgR)的存在是人乳腺癌最重要的预测和诊断标志物之一,统称为激素受体阳性。

[责任编辑:]

 Mettler-Toledo 在中国国际渔业博览会上展示创新的产品
Mettler-Toledo 在中国国际渔业博览会上展示创新的产品
 食品异物问题频发?是时候了解X射线检测了
食品异物问题频发?是时候了解X射线检测了
 开拓科技创新,撬动橡塑业高质量发展
开拓科技创新,撬动橡塑业高质量发展
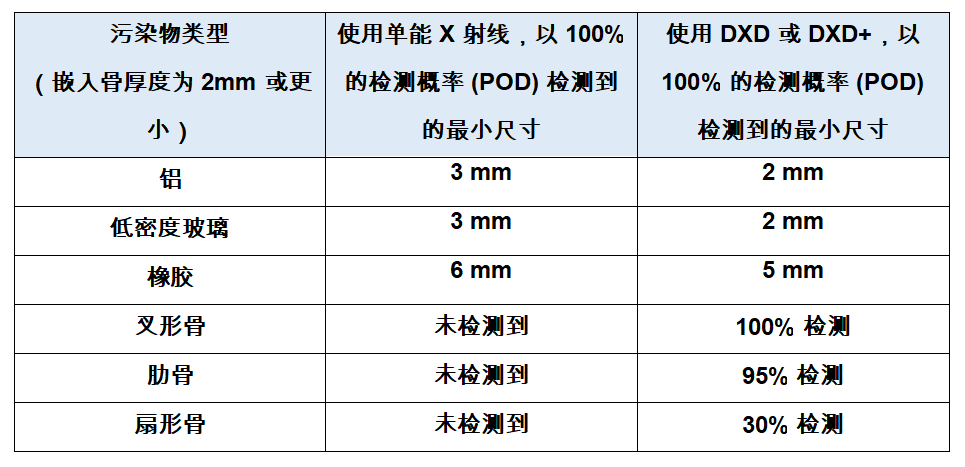 梅特勒托利多针对“难以发现”的污染物推出高品质X射线检
梅特勒托利多针对“难以发现”的污染物推出高品质X射线检
 探索婴幼儿辅食市场高质量发展之路,为宝宝成长保驾护航
探索婴幼儿辅食市场高质量发展之路,为宝宝成长保驾护航
 《食品安全最佳实践白皮书(2021-2022年)》四大主题发布
《食品安全最佳实践白皮书(2021-2022年)》四大主题发布
 《保健食品真实世界研究通则》团标技术审查与特食跨
《保健食品真实世界研究通则》团标技术审查与特食跨
 凝聚全球食饮智慧 SIAL西雅展国际化水平再创新高
凝聚全球食饮智慧 SIAL西雅展国际化水平再创新高
 精准把控 高质发展,第三届微生物安全与应用会议在
精准把控 高质发展,第三届微生物安全与应用会议在
 《食品行业科技创新白皮书》重磅发布!
《食品行业科技创新白皮书》重磅发布!






参与评论