复方多糖的葡聚糖凝胶分离及纯度鉴定
□ 郑亚玲 新疆水产科学研究所(新疆维吾尔自治区水产品质量检测中心)
摘 要:本文研究了在离子交换分离的基础上,用葡聚糖凝胶色谱进一步优化分离纯化复方多糖的方法和条件,从而建立葡聚糖凝胶分离此复方多糖的最佳条件。本实验主要对洗脱液的浓度进行选择,分别用不同浓度的NaCl溶液为洗脱剂,根据所得吸光度曲线的峰形及对称情况,判断出最佳的洗脱剂浓度为0.2mol·L-1NaCl溶液;再将分离纯化所得的复方多糖用纸层析法、紫外-可见吸收光谱、凝胶色谱法进行纯度鉴定,经鉴定可知分离所得的复方多糖为均一组分。
关键词:多糖 分离纯化 纯度鉴定
多糖广泛存在于动物细胞膜、植物和微生物细胞壁中,是一类天然高分子化合物,其在抗肿瘤、抗病毒、抗辐射、抗溃疡、降血糖及免疫调节等方面有良好的应用前景[1]。
凝胶色谱[2]又称分子筛色谱,凝胶柱色谱法常用的凝胶有葡聚糖凝胶和琼脂糖凝胶,以不同浓度的盐溶液和缓冲溶液作为洗脱剂,可使不同大小的多糖分子得到分离纯化,但不适宜粘多糖的分离[3]。多糖是极性大分子化合物,具有分子量、组成、聚合度、分子形状不均一的特点[4]。测定多糖纯度的方法有功能团分析、比旋光度、水解后糖组分分析、纸色谱、紫外-可见吸收光谱法和高效液相色谱、超离心和高压电泳、超离心分析法等[2]。
1检测方法
1.1 纸色谱法
纸色谱法[5]是以滤纸作为载体,让样品溶液在滤纸上展开。纸色谱的溶剂由有机溶剂和水组成,当有机溶剂和水部分溶解时则有两种可能——一相是以水饱和的有机溶剂相,一相是以有机溶剂饱和的水相。纸色谱中的流动相是指层析液在毛细拉力作用下能不断由下向上流动,固定相是指被吸附在滤纸纤维之间的水分。由于纤维素上的羟基具有亲水性,故使这部分水束缚在纤维素周围,不易扩散而成为固定相。在层析过程中,当层析液在毛细拉力作用下上升,流经色素滤液细线时,滤液细线上的色素就相继溶入层析液,随着层析液上升发生再分配,即有一部分色素从层析液分配溶解到固定相中,直到平衡。由于分配系数不同,那些分配系数大的色素分子随层析液向上移动得快,形成的色素带集中在滤纸上部;而分配系数小的色素分子,随层析向上移动得慢,形成的色素带集中在滤纸下面。
1.2 紫外-可见吸收光谱法
一种纯物质在一定条件、一定波长范围内,它的吸收光谱是一定的。根据物质吸收光谱最大吸收峰波长的位置或吸收峰形状和数量,可以判断该物质的纯度。对于某些生物大分子(如核酸和蛋白质),可以根据他们在紫外光区的特征吸收峰波长(如核酸260nm,蛋白质280nm)处测得吸光值,可通过求二者吸光值的比值来判断纯度。
1.3 凝胶色谱法
凝胶色谱也可用于多糖的纯度鉴定——若经凝胶色谱得到单一对称峰,说明该多糖为均一组分。
2 实验仪器和材料
仪器:电子天平、紫外-可见分光光度计、超声波清洗器、电热真空干燥箱、层析柱(3cm×100cm)、层析缸(7cm×25cm)。
试剂:葡聚糖凝胶、磷酸、正丁醇、丙酮、醋酸、氯化钠、浓硫酸、苯酚、苯胺、锌粉等(均为分析纯试剂)。
原料:复方多糖样品(已经过离子交换树脂初步分离)。
3 实验方法
3.1 多糖的分离纯化
3.1.1 装柱、平衡
称取葡聚糖干粉20.0g,在90℃蒸馏水中溶胀5h。溶胀平衡后,在凝胶颗粒面上加较多的水,用搅棒将凝胶搅匀,放置数分钟,将沉降很慢的细颗粒随上层水到掉,如此反复至上层没有细颗粒为止。向洗好的凝胶中加入2倍凝胶体积的NaCl溶液,放置于80℃水中加热30~40min以排除凝胶溶液中的气泡,同时,另取200mL同浓度的NaCl溶液在80℃水中加热以排除溶液中的气泡,以备装柱时用。
除完气泡后,选长为100.0cm、外径为3.0cm的层析柱开始装柱。将除好气泡的200mL NaCl溶液倒入柱中,再将已做好的薄棉花片铺于柱底,把凝胶溶液搅匀倒进柱中,待柱底面上积起约1~2cm的凝胶床后,打开柱的出口,随着下面水的流出上面不断加入凝胶,并不断轻敲四周柱壁,使形成的凝胶床面上有均匀连续的凝胶降下,得到均匀的凝胶柱。装好凝胶柱后,量算出有效柱体积,用3~5倍柱体积的NaCl溶液平衡凝胶柱。
3.1.2 上样、洗脱
取0.1g样品溶于0.1mol·L-1的NaCl溶液中,使其体积为柱体积的0.5%,将凝胶柱层面上的洗脱液放出至距床面小于0.5mm时,用移液管将配制好的样品溶液逐滴加在床面上,使样品溶液均匀平铺在凝胶床面上,待样品溶液完全进入凝胶柱后,向床面上缓缓加上10cm高的洗脱液,再逐滴加入洗脱液进行洗脱,使加入洗脱液的速度与凝胶柱流速相等。
计算凝胶柱流速及每分钟流出的体积,每流出3mL收集一次,至流出液呈无色为止,停止收集。再分别用0.2mol·L-1、0.3mol·L-1、0.4mol·L-1、0.5mol·L-1 NaCl溶液重复进行上述实验步骤。
3.1.3 洗脱剂浓度的选择
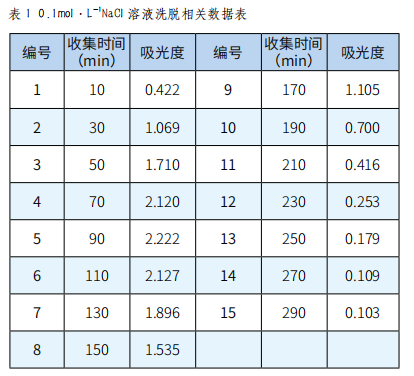
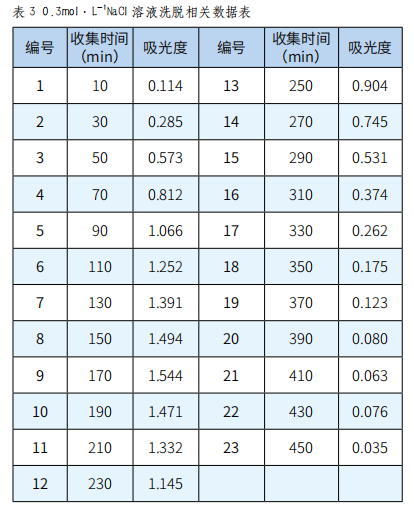
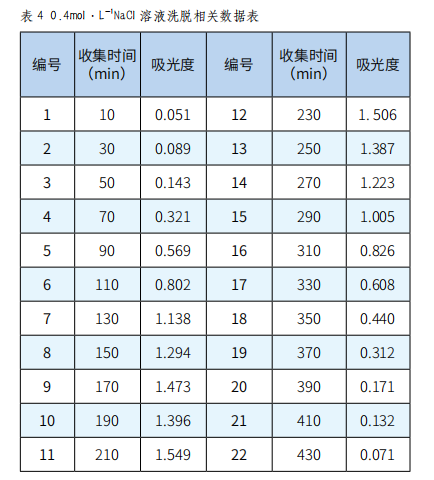
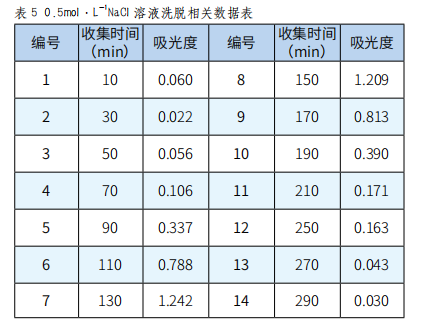
分别取收集的各瓶样品溶液0.1mL,再依次加入1.0mL 5%苯酚、0.9mL蒸馏水和5.0mL浓硫酸,放置20min显色后,在490nm下测其吸光度,并绘制吸收曲线,根据吸收曲线选择最佳的洗脱剂浓度(实验结果见图表1~5)。

3.2 纯度鉴定
3.2.1 紫外光谱法
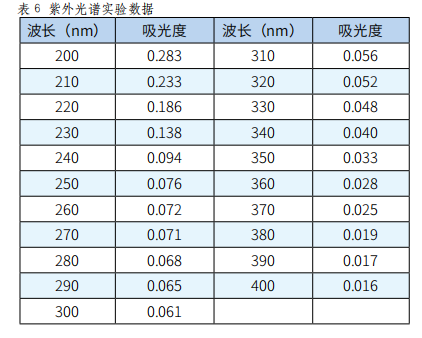
用电光天平称取葡聚糖凝胶分离后的多糖0.0201g,配制成100mL溶液。取配制好的多糖溶液3.5mL、蒸馏水3.5mL,用紫外-可见分光光度计在200~400nm范围内每10nm测一次吸光度(实验结果见表6)。
3.2.2 凝胶色谱法
取葡聚糖凝胶分离后的多糖0.1g溶于7mL 0.2mol·L-1 NaCl溶液中,上SephadexG-200层析柱(3.0×60cm),用0.2mol·L-1 NaCl溶液洗脱,流速为54s/滴,分步收集,每30min收集一次,至流出液呈无色为止,停止收集,用苯酚-硫酸法检测(实验结果见表7、图6)。
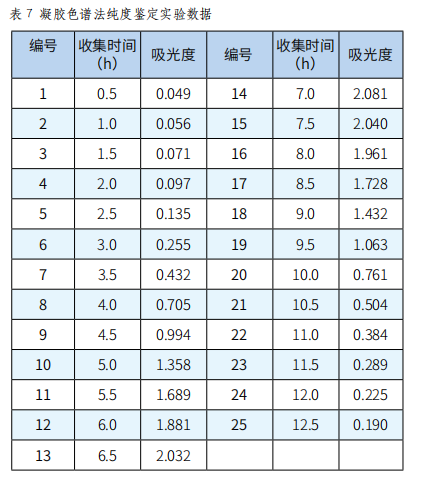
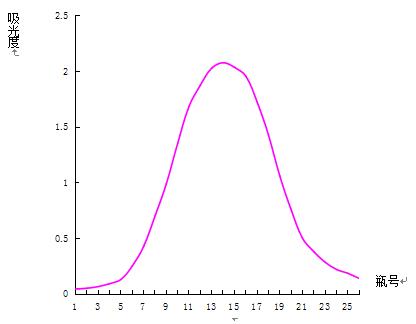
图6 凝胶色谱法纯度鉴定洗脱曲线
3.2.3 纸层析法
称取葡聚糖凝胶分离后的多糖0.0502g,加入10mL蒸馏水配成0.5%多糖溶液,滤纸尺寸为(4cm×23cm),以正丁醇:乙醇:水=4:1:5为展开剂,室温展开6h,苯胺磷酸盐为显色剂,100℃,显色10min。
4. 实验结果与讨论
4.1 洗脱效果与讨论
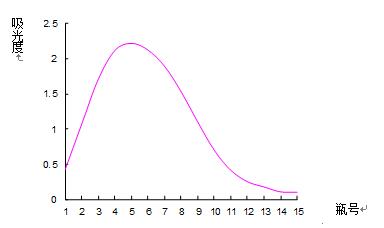
图1 0.1mol·L-1 NaCl溶液洗脱曲线
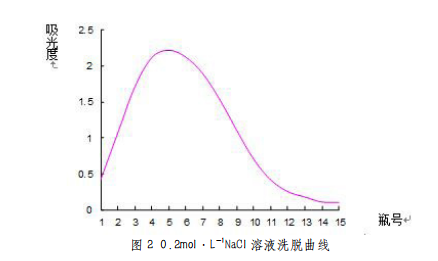

图3 0.3mol·L-1 NaCl溶液洗脱曲线

图4 0.4mol·L-1 NaCl溶液洗脱曲线
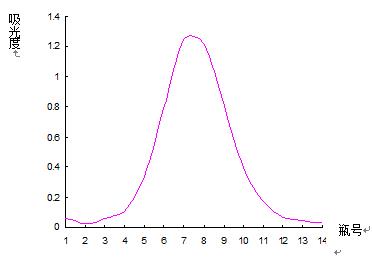
图5 0.4mol·L-1 NaCl溶液洗脱曲线
由图1、图2、图3、图4、图5可以看出,以0.2mol·L-1 NaCl溶液为洗脱剂所得的曲线峰形及对称性较好,因此可确定用葡聚糖凝胶分离复方免疫增强剂中多糖的最佳洗脱剂为0.2mol·L-1的NaCl溶液。
4.2 纯度鉴定结果与讨论
4.2.1 紫外光谱法
由以上数据可以看出,在260nm和280nm处样品无吸收峰,说明此多糖样品中不含蛋白质和核酸。
4.2.2 凝胶色谱法
由以上数据和图形可以看出,得到的曲线是单一对称峰,说明此多糖样品为均一组分。
4.2.3 纸层析
经显色烘干后可见滤纸上只有一个斑点,可说明此多糖样品为均一组分。
5 结论
以0.2mol·L-1的NaCl溶液为洗脱剂,使用Sephadex G-200可有效分离纯化复方免疫增强剂中多糖,达到最佳分离效果。
经紫外光谱法、凝胶色谱法、纸层析法、旋光度法鉴定,由Sephadex G-200分离纯化出的复方多糖为均一组分。
参考文献:
[1] 傅博强,谢明勇,周鹏.茶叶多糖的提取纯化、组成及药理作用研究进展.南昌大学学报(理科版),2001,25(4):358-364.
[2] 林卓坤.色谱法(一),科学出版社,1982.1:61-69.
[3] 甘璐,张声华.枸杞多糖纯度与四个级分含量的测定.食品科学,1999.1:52-53.
[4] 张林维,赵帜平,沈业寿.当归多糖的分离纯化及其部分性质的研究.生物学杂志,1998,15(3):12-14.
[5] 周光碗,胡晓倩.生物化学仪器分析与实验技术.化学工业出版社,2003:9-22.

[责任编辑:]
相关阅读
- (2018-05-01)索氏法提取蛹虫草子实体多糖的工艺研究
 盒装水果省事不卫生 实验解释3大疑问
盒装水果省事不卫生 实验解释3大疑问
 “食安中国网”手机站上线通知
“食安中国网”手机站上线通知
 食安中国网关于2015年春节放假的通知
食安中国网关于2015年春节放假的通知
 2017年《食品安全导刊》线上征订开始啦!
2017年《食品安全导刊》线上征订开始啦!
 扫“食安中国”官方微信,送《食品安全导刊》杂志
扫“食安中国”官方微信,送《食品安全导刊》杂志
 外卖小哥见店面脏乱差取餐后实名举报黑外卖,该店已
外卖小哥见店面脏乱差取餐后实名举报黑外卖,该店已
 南京这栋外卖楼每天喂饱一万人:厨房挨在一起,卫生
南京这栋外卖楼每天喂饱一万人:厨房挨在一起,卫生
 江苏省食品药品监督管理局召开警示教育大会
江苏省食品药品监督管理局召开警示教育大会
 你期待的“网红奶茶”抽检结果权威发布!
你期待的“网红奶茶”抽检结果权威发布!
 国家市场监管总局“三定”方案出台:设局长1名,副
国家市场监管总局“三定”方案出台:设局长1名,副





参与评论