江香薷乙酸乙酯成分及其抑制α-葡萄糖苷酶活性分析
邹 毅,潘建萍,周 敏
(赣南卫生健康职业学院,江西赣州 341000)
摘 要:研究江香薷中抑制α-葡萄糖苷酶活性成分,采用硅胶柱层析、葡聚糖凝胶柱色谱、重结晶等方法从江香薷乙酸乙酯部位分离纯化出单体化合物,根据化合物理化性质及波谱数据鉴定化学结构,采用4-硝基酚-α-D-吡喃葡萄糖苷(PNPG)法进行α-葡萄糖苷酶抑制活性评价。结果表明,从江香薷乙酸乙酯部位分离得到7个化合物,分别为南烛树脂酚(1)、(-)-5-甲氧基异落叶松树脂素((-)-5-methoxyisolariciresinol)(2)、松脂醇(Pinoresinol)(3)、isoeucommin A(4)、丁香树脂醇-4-O-β-D-吡喃葡萄糖苷(Episyringaresinol-4-O-β-D-glucopyranoside)(5)、槲皮素(6)、山奈酚(7),化合物1~5为首次从该植物中分离得到。体外α-葡萄糖苷酶抑制活性实验结果显示,化合物1、7对α-葡萄糖苷酶的抑制率达到86%以上,50分别为(47.15±0.41)mg/L、(42.34±0.62)mg/L,化合物6的抑制率为94.11%,50是(39.28±0.30)mg/L,活性与阳性对照组Acarbose相当。化合物1为竞争性抑制,化合物6、7为非竞争抑制。
关键词:江香薷;化学成分;α-葡萄糖苷酶抑制活性
江香薷(Mosla chinensis)为唇形科石荠苎属植物,以干燥地上部分入药,属药食同源品种,为江西省的大宗药材之一,主产于新余市分宜县和渝水区等地。江香薷味辛,微温,具有发汗解表,化湿和中的功效,可用于治疗暑湿感冒、恶寒发热、头痛无汗、腹痛吐泻、水肿、小便不利等病症[1]。国内外关于该植物的形态、资源、化学成分及生物活性研究报道较多,且发现该植物包含挥发油、生物碱、苷类、多糖、黄酮等多种化学成分,具有抗菌、调血脂、降糖、抗氧化、提高免疫力等药理活性[2-3]。然而,目前研究多集中于具有抗炎、抗病毒等活性的挥发油成分的研究,对于其他成分的药理活性研究报道甚少。α-葡萄糖苷酶抑制剂(AGI)是治疗Ⅱ型糖尿病(DM)常用的口服药物,目前已上市的有阿卡波糖、伏格列波糖等,但其胃肠道方面副作用明显,从天然产物中筛选新的AGI的研究越来越受到广泛关注。本课题组从江香薷中分离了7个化合物,并从中筛选出具有较强抑制α-葡萄糖苷酶活性的化合物。
1 材料及仪器
江香薷全草于2020年采自新余市分宜县,全草性状符合相关文献描述[2],经赣南医学院副教授胡海波鉴定为江香薷(Mosla chinensis)。
Inova 500型核磁共振仪,TMS内标;Shimadzu LC-6AD液相色谱仪,制备柱YMC-Pack ODS-A;HP-20大孔吸附树脂;LH-20型葡聚糖凝胶,Amersham Pharmacia Biotech公司;反相硅胶柱,日本YMC公司;柱色谱硅胶G;硅胶GF254;试剂为色谱纯或分析纯级别;MK3酶标仪(Thermo Lab systems公司);96孔板(上海一研生物科技有限公司);PNPG、阿卡波糖(纯度≥98%),上海研生实业有限公司。
2 提取分离
将6 kg干燥的江香薷地上部分切碎,用95%乙醇回流提取3次,合并提取液,减压浓缩至无醇味后得乙醇总浸膏。将总浸膏加水混悬,分别用石油醚、二氯甲烷、乙酸乙酯、正丁醇萃取。乙酸乙酯部位(38 g)经硅胶柱色谱(氯仿∶甲醇,1∶0→1∶1)梯度洗脱得到8个组分(A-H)。B组分(3.3 g)经硅胶柱色谱(石油醚∶乙酸乙酯,3∶1)、Sephadex LH-20柱色谱(甲醇)和制备液相色谱得化合物1(8.5 mg)、化合物2(5.2 mg)和化合物3(7.5 mg)。C组分(8.3 g)经硅胶柱色谱和制备液相色谱分别得化合物6(2.8 mg)和化合物
7(3.7 mg)。E组分(6.6 g)经Sephadex LH-20柱色谱(甲醇)、硅胶柱色谱(氯仿-甲醇-水,10∶1∶0.1)得到化合物4(3.8 mg)和化合物5(5.6 mg)。
3 化合物鉴定
从江香薷乙酸乙酯部位分离得到的化合物依据实验测试结果,鉴定结果如下,化合物结构如图1所示。
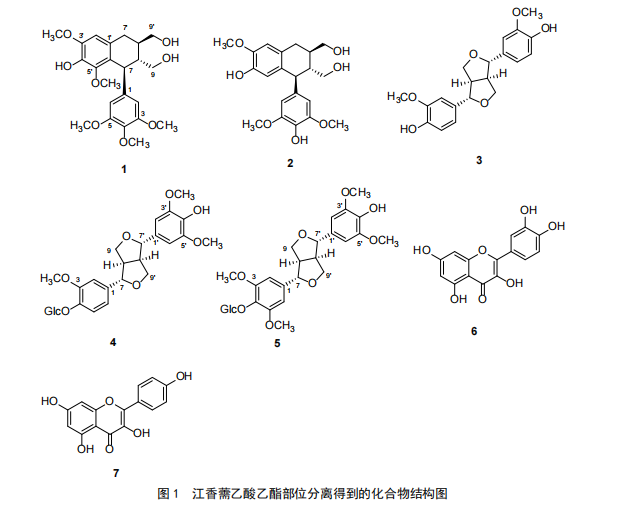
(1)化合物1。白色粉末,ESI-MS:435[M+H]+。1H-NMR(MeOH-4,500 MHz):6.60(1H,s,H-2′),
6.40(1H,s,H-2,6),4.32(1H,d,=5.5 Hz,H-7),2.71,2.59(each1H,m,H-7′),1.98(1H,m,H-8),1.64(1H,m,H-8′),3.60(2H,m,H-9),3.51(2H,m,H-9′),3.87(3H,s,3′-OMe),3.75(6H,s,3,5-OMe),3.39(3H,s,5′-OMe),4.84,4.40(2H,t,-CH2OH)。13C-NMR(MeOH-4,125 MHz)δ:139.3(C-1),106.9(C-2,6),149.0(C-3,5),134.5(C-4),42.3(C-7),49.8(C-8),64.2(C-9),130.2(C-1′),107.8(C-2′),148.7(C-3′),138.3(C-4′),147.7(C-5′),126.2(C-6′),33.6(C-7′),40.9(C-8′),66.8(C-9′),56.8(3,5-OMe),60.1(3′-OMe),56.6(5′-OMe)。以上数据与文献[3]报道一致,鉴定该化合物(+)lyoniresinol(南烛树脂酚)。
(2)化合物2。白色粉末,ESI-MS:383[M+Na]+,359[M-H]-。1H-NMR(DMSO-6,500 MHz):6.62(1H,d,=1.5 Hz,H-2),6.67(1H,d,=8 Hz,H-5),6.47(1H,dd,=8,1.5 Hz,H-6),3.73(1H,d,=9.5 Hz,H-7),1.83(1H,m,H-8),6.59(1H,s,H-2′),6.07(1H,s,H-5′),2.71~2.61(2H,m,H-7′),1.60(1H,m,H-8′),3.43(2H,m,H-9),3.14(1H,m,H-9′),3.56(1H,m,H-9′),3.68(3H,s,OMe-3),3.69(3H,s,OMe-3′),8.42,8.73(2H,s,Ar-OH),4.84,4.40(2H,t,-CH2OH);13C-NMR(DMSO-6,125 MHz):127.1(C-1),111.8(C-2),145.5(C-3),144.1(C-4),116.2(C-5),132.5(C-6),32.3(C-7),38.0(C-8),63.5(C-9),136.2(C-1′),106.6(C-2′),147.8(C-3′),133.7(C-4′),147.6(C-5′),106.6(C-6′),46.5(C-7′),45.7(C-8′),59.7(C-9′),55.5(OMe-3),56.0(OMe-3′,5′)。以上数据与文献[4]报道一致,鉴定该化合物为(-)-5-甲氧基异落叶松树脂素((-)-5-methoxyisolariciresinol)。
(3)化合物3。无色油状,ESI-MS:381[M+Na]+,1H-NMR(500 Mz,CDCl3):6.80~6.89(6H,Ar-H),4.78(2H,d,=4.0 Hz,H-7,7′),4.28(2H,dd,=9.0,7.0 Hz,H-9a,9a′),3.91(2H,dd,=9.0,7.0 Hz,H-9b,9b′),3.96(6H,s,3,3′-OCH3),3.15(2H,m,H-8,8′)。13C-NMR(150 Mz,CDCl3):133.1(C-1,1′),108.7(C-2,2′),146.8(C-3,3′),145.4(C-4,4′),114.4(C-5,5′),119.1(C-6,6′),86.0(C-7,7′),54.3(C-8,8′),71.8(C-9,9′),56.1(3,3′-OCH3)。以上数据与文献[5]报道一致,鉴定该化合物为pinoresinol(松脂醇)。
(4)化合物4。白色粉末,1H-NMR(500 Mz,MeOH-4):7.02(1H,brs,H-2),7.14(1H,d,=8.0 Hz,H-5),6.91(1H,d,=8.0,1.5 Hz,H-6),6.65(2H,s,H-2′,6′),4.75(1H,brs,H-7),4.71(1H,brs,H-7′),4.25,3.88(each 1H,m,H-9),3.68,3.40(each 1H,m,H-9′),3.12(2H,brs,H-8,8′),3.86(3H,s,3-OCH3),3.84(6H,s,3′,5′-OCH3),4.87(1H,d,=7.0 Hz,Glc-1)。13C-NMR(125 Mz,MeOH-4):136.2(C-1),111.6(C-2),151.0(C-3),147.5(C-4),118.0(C-5),119.8(C-6),87.0(C-7),55.5(C-8),72.8(C-9),133.1(C-1′),104.5(C-2′,6′),149.3(C-3′,5′),137.5(C-4′),87.6(C-7′),55.5(C-8′),72.7(C-9′),56.8(3-OCH3),56.8(3′,5′-OCH3),102.8(Glc-1),74.9(Glc-2),77.8(Glc-3),71.3(Glc-4),78.2(Glc-5),62.5(Glc-6)。以上数据与文献[6]报道一致,鉴定该化合物为isoeucommin A。
(5)化合物5。白色粉末,1H-NMR(500 Mz,DMSO-6)
:6.67(2H,brs,H-2,6),6.61(2H,s,H-2′,6′),4.71(1H,brs,H-7),4.63(1H,brs,H-7′),4.19,3.80(each 2H,m,H-9,9′),3.06(2H,brs,H-8,8′),3.77(6H,s,3,5-OCH3),3.76(6H,s,3′,5′-OCH3),4.90(1H,d,=7.0 Hz,Glc-1)。13C-NMR(125 Mz,DMSO-6):137.3(C-1),103.7(C-2,6),152.7(C-3,5),133.8(C-4),85.1(C-7),53.7(C-8),71.3(C-9),131.3(C-1′),102.7(C-2′,6′),148.0(C-3′,5′),135.0(C-4′),85.4(C-7′),53.7(C-8′),71.2(C-9′),56.5(3,5-OCH3),56.1(3′,5′-OCH3),104.2(Glc-1),74.2(Glc-2),76.6(Glc-3),71.2(Glc-4),77.3(Glc-5),61.0(Glc-6)。以上数据与文献[7]报道一致,鉴定该化合物为丁香树脂醇-4-O-β-D-吡喃葡萄糖苷(episyringaresinol-4-O-β-D-glucopyranoside)。
(6)化合物6。黄色粉末,1HNMR(400 MHz,DMSO):7.67(1H,d,=2.0 Hz,H-2′),7.55(1H,dd,J=8.4,2.0 Hz,H-6′),6.89(1H,d,J=8.4 Hz,H-5′),6.39(1H,brs,H-8),6.18(1H,brs,H-6),以上数据与文献[8]报道一致,鉴定该化合物为槲皮素(quercertin)。
(7)化合物7。黄色粉末,1HNMR(400 MHz,DMSO):8.04(1H,d,=8.0 Hz,H-2′,6′),6.91(1H,d,=8.0 Hz,H-3′,5′),6.40(1H,brs,H-8),6.16(1H,brs,H-6),以上数据与文献报道一致,鉴定该化合物为山奈酚(kaempferol)。
4 抑制α-葡萄糖苷酶活性的筛选
参考文献[9]方法,以PNPG为底物,在96微孔板上测定α-葡萄糖苷酶活性,并用阿卡波糖作为阳性对照。取102 μL磷酸钾缓冲液(pH6.8),加入6 μLDMSO,15 μLα-葡萄糖苷酶(0.1 U/mL),恒温(37 ℃)反应10 min,加入15 μLPNPG(1.2 mmol/L),恒温(37 ℃)反应10 min,加60 μLNa2CO3,在405 nm 波长处测吸光度值。计算酶活性抑制率=[1-(样品组-样品空白组)/(阴性组-空白组)]×100%,用Origin6.0求对应的50。酶活性抑制作用结果见表1,由表可知,化合物1、6、7对α-葡萄糖苷酶活性抑制作用较强,其抑制率分别为88.57%、94.11%、90.18%。50分别为(47.15±0.41)mg/L、(39.28±0.30)mg/L、(42.34±0.62)mg/L。

5 酶抑制类型的确定
分别取化合物1、6、7两个不同浓度,PNPG取4个不同浓度,根据Lineweave-Burk作图法,分别绘制3个化合物的抑制作用动力学曲线,见图2、图3和图4。
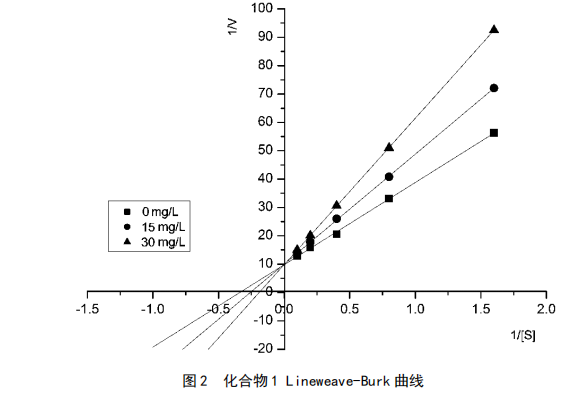
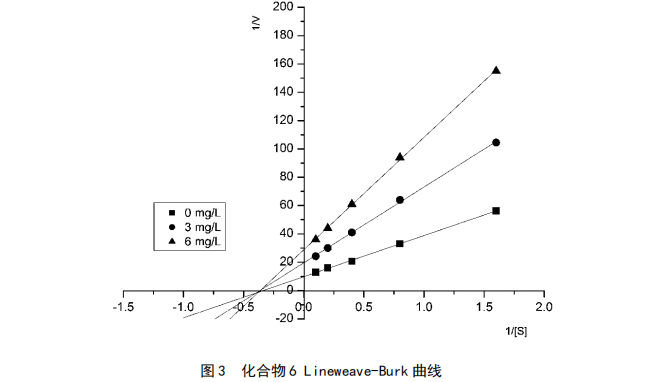

由上图可知,化合物1对α-葡萄糖苷酶抑制作用为竞争性抑制,化合物浓度增大而反应速度max不变,根据竞争性抑制动力学方程计算其Ki为37.6 mg/L。化合物6、7则属于非竞争性抑制剂,max随浓度的增大而减小,根据非竞争性抑制动力学方程求出2个化合物的Ki分别为
156.2 mg/L、3.09 mg/L。
6 结论
目前对于江香薷多集中于具有抗炎、抗病毒等活性的挥发油成分的研究,而本课题首次利用体外筛选模型对江香薷乙酸乙酯萃取物抑制α-葡萄糖苷酶活性成分进行了研究,从中分离鉴定出7个化合物。其中,化合物1~5为首次从该植物中分离得到。利用96微孔板PNPG法评价化合物对α-葡萄糖苷酶的抑制活性,筛选出较强抑制酶活性的化合物1、6、7,其中化合物1属于竞争性抑制,化合物6、7属于非竞争性抑制。本研究有助于加快江香薷资源的现代化开发,并为深入研究天然AGI药物提供方向。
参考文献
[1]国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2005.
[2]陈钟文,吴文茂,等.药用香薷类植物化学成分的研究[J].中国实验方剂学杂志,2011,17(24):260-264.
[3]姚奕,许浚,黄广欣,等.香薷的研究进展及其质量标志物预测分析[J].中草药,2020,51(10):2661-2670.
[4]刘波,刘明韬,甘茂罗,等.瑶山润楠根的化学成分研究[J].中国中药杂志,2012,37(9):1227-1231.
[5]王瑞,童玲,师彦平.芫花中1个新的四氢呋喃型木脂素[J].中草药,2016,47(14):2408-2411.
[6]杨美珍,王晓琴,李超.弯管列当的化学成分研究[J].中草药,2014,45(17):2447-2452.
[7]王威,刘小红,高华,等.东北铁线莲地上部位化学成分研究[J].中草药,2014,45(17):2440-2446.
[8]倪付勇,陈重,许琼明,等.高山红景天化学成分研究[J].中草药,2013,44(7):798-802.
[9]李婷,张小东,宋聿文,等.一种用微孔板筛选alpha-葡萄糖苷酶抑制剂的方法(英文)[J].中国临床药理学与治疗学,2005(10):1128-1134.
作者简介:邹毅(1983—),男,江西瑞金人,硕士,讲师。研究方向:天然药物活性物质产业化开发。

相关热词搜索:
[责任编辑:]

 《食品安全最佳实践白皮书(2021-2022年)》四大主题发布
《食品安全最佳实践白皮书(2021-2022年)》四大主题发布
 挪帝克开设京东旗舰店 与京东全球购达成战略合作
挪帝克开设京东旗舰店 与京东全球购达成战略合作
 2019《食品安全导刊》杂志订阅返百元红包!
2019《食品安全导刊》杂志订阅返百元红包!
 9月大事 | 市场监管总局开展2018年全国“质量月”活动
9月大事 | 市场监管总局开展2018年全国“质量月”活动
 盒装水果省事不卫生 实验解释3大疑问
盒装水果省事不卫生 实验解释3大疑问
 “食安中国网”手机站上线通知
“食安中国网”手机站上线通知
 小个头 大营养 禾泱泱有机稻鸭原生小泱胚芽米 金
小个头 大营养 禾泱泱有机稻鸭原生小泱胚芽米 金
 全球食品创新平台第五期已启动,携手共创安全、健康
全球食品创新平台第五期已启动,携手共创安全、健康
 食品安全新动向讲座:权威解读食品安全中的过敏原问
食品安全新动向讲座:权威解读食品安全中的过敏原问
 【采访ADM】力行不辍、多元发展,满足消费者的营养
【采访ADM】力行不辍、多元发展,满足消费者的营养






参与评论