肉制品中致病菌的检测与荧光定量PCR方法
检测肉制品中的致病菌是保障肉制品质量安全、防止食源性疾病爆发的有效手段。PCR技术作为一种同时检测多种病原菌的技术,是检测肉制品中致病菌的重要手段。此次主题由刘磊老师对肉制品致病菌的各种知识和荧光定量PCR方法进行讲解。
食源性致病菌及其危害
食源性疾病是指食品中致病因素进入人体引起的感染性、中毒性等疾病,包括食物中毒。据不完全统计,约66%的食源性疾病由食源性微生物引起。据WHO(世界卫生组织)估计,全球每年有数十亿人发生食源性疾病,每年美国大约有7600万人患食源性疾病。
微生物种类主要分为两类,其一为致腐性微生物,如蜡样芽孢杆菌、枯草杆菌、大肠杆菌、变形杆菌、铜绿假单胞菌、金黄色葡萄球菌、微球菌、真菌等,其二是致病性微生物,如李斯特菌、沙门氏菌、志贺氏菌、致病性大肠杆菌、链球菌、空肠弯曲菌、副溶血弧菌小肠结肠炎耶尔森菌
在人们的日常生活中,肉制品是人体中微生物的一大重要来源。肉制品中的微生物的主要有三方面来源—动物本身由于疾病或者创伤感染引入;屠宰、分割过程中引入的(水、肠道、呼吸道、工具、操作人员、空气,鼠类及蝇虫等);制作过程中由配料带入。
致病菌限量标准及GB检测方法
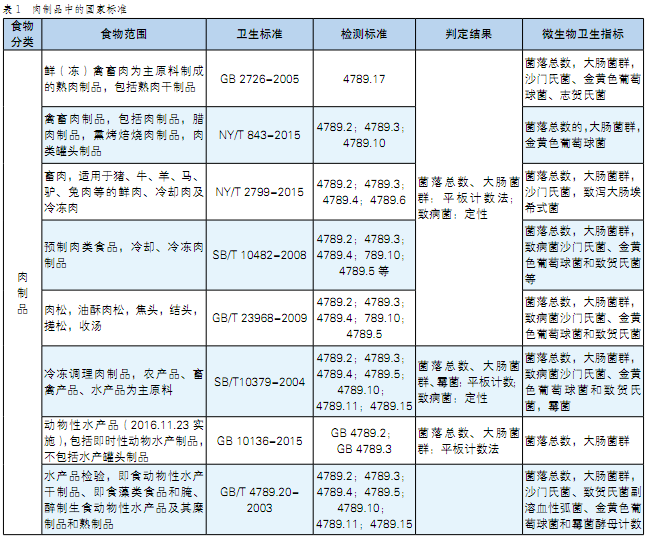
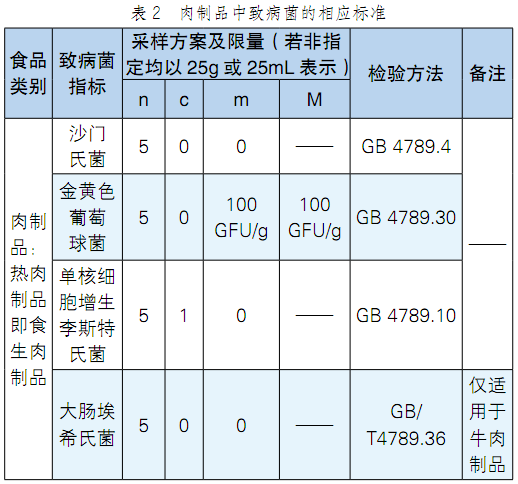
我国关于致病菌的限量标准以国家标准(GB)为主,主要包括GB 4789(检测方法)、GB 29921(致病菌限量标准)、产品标准、卫生规范GB 14811和接触材料标准。除此之外,还有相关的行业标准(SN)、农业部标准(NY)和地方标准(DB)。肉制品中的国家标准详见表1,肉制品中致病菌的相应标准如表2所示。
 食源性致病菌检测方法及其选择使用
食源性致病菌检测方法及其选择使用
图1以沙门氏菌为例,解释了食源性致病菌的大致检测流程。
食源性致病菌的检测方法大致可分为三类,即培养法、免疫法、PCR。培养法是致病菌检测行业的金标准,但是比较繁琐,并且检测周期长,同时要求新鲜样本;免疫法同样是行业金标准,但是检测结果存在人为差异;使用PCR方法具有非特异性干扰的特点,并且检测灵敏度很高。不同的检测需求各自适应着三种检测方法,而每种检测方法也有着选用的适合条件。检测方法的选取大致需要考虑四点,第一,检测样品:检测方法均具有一定的适用范围,例如检测诺如病毒的ELISA试剂盒适用范围为粪便、制定为检测蔬菜的行标则不适用;又如在沙门氏菌检验中低菌量样品可以一步增菌。第二,检测项目:例如,致泻性大肠杆菌适宜采用PCR方法检验,金葡肠毒素则适合采用免疫方法检测。第三,样品数量:检测样品数量大、建议采用免疫学方法,例如ELISA。第四,实验室预算:预算少,可以采用不需要仪器的免疫学方法或者恒温PCR方法。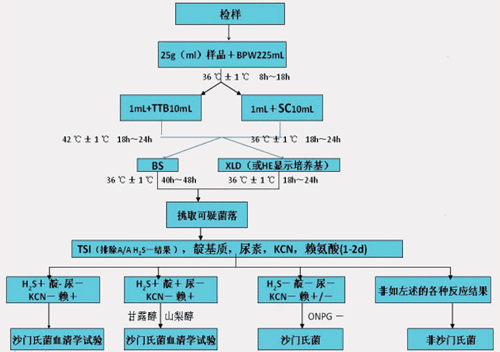 MF荧光定量PCR产品
MF荧光定量PCR产品
实时荧光PCR是在PCR反应体系中加入荧光基团,利用荧光信号累积实现实时监测整个PCR进程,并对起始模板进行定量分析的方法,而普通PCR则是借助DNA电泳对扩增反应的终产物进行半定量及定性分析。实时荧光PCR与普通RT-PCR相比,优势在于实时监测(在对数扩增期)而不是重点检测,且其灵敏度更高,需要样品也较少,特异性高,还能够精确定量。此外,实时荧光PCR无需接触EB等有害物质,检测过程在密闭的反应管中进行,可以减少对环境中气溶胶的污染,提高检测结果的准确性。
就操作流程而言,MF荧光定量PCR产品操作可分为六步—取样、样品前处理、核酸提取(5min)、反应体系配置(预制型)、扩增检测(1.5~2h)、结果判断。从产品优点看,MF荧光定量PCR也有六大优势:第一、结果精确:采用独特且高度保守等基因靶序列检测,特异性强,灵敏度高,可达到10~100CFU/ML。第二、操作便捷:一次加样、检测,减少人为误差。第三、检测快速:整个扩增、检测时间1.5~2h。第四、降低污染:封闭的体系中完成扩增和实时测定,大大降低了污染的可能性。第五、精准的控温系统:先进的热电制冷技术,保证超高热循环系统加热,制冷迅速、稳定,多温度控制。第六、试剂盒通用性强:适用于多种荧光定量PCR仪,不同探针和引物组合。
食源性致病菌及其危害
食源性疾病是指食品中致病因素进入人体引起的感染性、中毒性等疾病,包括食物中毒。据不完全统计,约66%的食源性疾病由食源性微生物引起。据WHO(世界卫生组织)估计,全球每年有数十亿人发生食源性疾病,每年美国大约有7600万人患食源性疾病。
微生物种类主要分为两类,其一为致腐性微生物,如蜡样芽孢杆菌、枯草杆菌、大肠杆菌、变形杆菌、铜绿假单胞菌、金黄色葡萄球菌、微球菌、真菌等,其二是致病性微生物,如李斯特菌、沙门氏菌、志贺氏菌、致病性大肠杆菌、链球菌、空肠弯曲菌、副溶血弧菌小肠结肠炎耶尔森菌
在人们的日常生活中,肉制品是人体中微生物的一大重要来源。肉制品中的微生物的主要有三方面来源—动物本身由于疾病或者创伤感染引入;屠宰、分割过程中引入的(水、肠道、呼吸道、工具、操作人员、空气,鼠类及蝇虫等);制作过程中由配料带入。
致病菌限量标准及GB检测方法
我国关于致病菌的限量标准以国家标准(GB)为主,主要包括GB 4789(检测方法)、GB 29921(致病菌限量标准)、产品标准、卫生规范GB 14811和接触材料标准。除此之外,还有相关的行业标准(SN)、农业部标准(NY)和地方标准(DB)。肉制品中的国家标准详见表1,肉制品中致病菌的相应标准如表2所示。


图1以沙门氏菌为例,解释了食源性致病菌的大致检测流程。
食源性致病菌的检测方法大致可分为三类,即培养法、免疫法、PCR。培养法是致病菌检测行业的金标准,但是比较繁琐,并且检测周期长,同时要求新鲜样本;免疫法同样是行业金标准,但是检测结果存在人为差异;使用PCR方法具有非特异性干扰的特点,并且检测灵敏度很高。不同的检测需求各自适应着三种检测方法,而每种检测方法也有着选用的适合条件。检测方法的选取大致需要考虑四点,第一,检测样品:检测方法均具有一定的适用范围,例如检测诺如病毒的ELISA试剂盒适用范围为粪便、制定为检测蔬菜的行标则不适用;又如在沙门氏菌检验中低菌量样品可以一步增菌。第二,检测项目:例如,致泻性大肠杆菌适宜采用PCR方法检验,金葡肠毒素则适合采用免疫方法检测。第三,样品数量:检测样品数量大、建议采用免疫学方法,例如ELISA。第四,实验室预算:预算少,可以采用不需要仪器的免疫学方法或者恒温PCR方法。

实时荧光PCR是在PCR反应体系中加入荧光基团,利用荧光信号累积实现实时监测整个PCR进程,并对起始模板进行定量分析的方法,而普通PCR则是借助DNA电泳对扩增反应的终产物进行半定量及定性分析。实时荧光PCR与普通RT-PCR相比,优势在于实时监测(在对数扩增期)而不是重点检测,且其灵敏度更高,需要样品也较少,特异性高,还能够精确定量。此外,实时荧光PCR无需接触EB等有害物质,检测过程在密闭的反应管中进行,可以减少对环境中气溶胶的污染,提高检测结果的准确性。
就操作流程而言,MF荧光定量PCR产品操作可分为六步—取样、样品前处理、核酸提取(5min)、反应体系配置(预制型)、扩增检测(1.5~2h)、结果判断。从产品优点看,MF荧光定量PCR也有六大优势:第一、结果精确:采用独特且高度保守等基因靶序列检测,特异性强,灵敏度高,可达到10~100CFU/ML。第二、操作便捷:一次加样、检测,减少人为误差。第三、检测快速:整个扩增、检测时间1.5~2h。第四、降低污染:封闭的体系中完成扩增和实时测定,大大降低了污染的可能性。第五、精准的控温系统:先进的热电制冷技术,保证超高热循环系统加热,制冷迅速、稳定,多温度控制。第六、试剂盒通用性强:适用于多种荧光定量PCR仪,不同探针和引物组合。

[责任编辑:]

相关阅读
- (2015-01-14)刘秀梅:不重视对致病菌污染的报道,会引起不科学的导向
- (2014-11-24)以双汇为例来看2013年肉制品行业发展现状分析
- (2015-09-02)金锣肉制品被检出瘦肉精西马特罗
- (2015-12-03)IFFA全球肉制品行业翘首以盼的舞台
- (2016-07-18)2015年乌鲁木齐市售熟肉制品、 酱腌菜中亚硝酸盐含量调查
 Mettler-Toledo 在中国国际渔业博览会上展示创新的产品
Mettler-Toledo 在中国国际渔业博览会上展示创新的产品
 食品异物问题频发?是时候了解X射线检测了
食品异物问题频发?是时候了解X射线检测了
 开拓科技创新,撬动橡塑业高质量发展
开拓科技创新,撬动橡塑业高质量发展
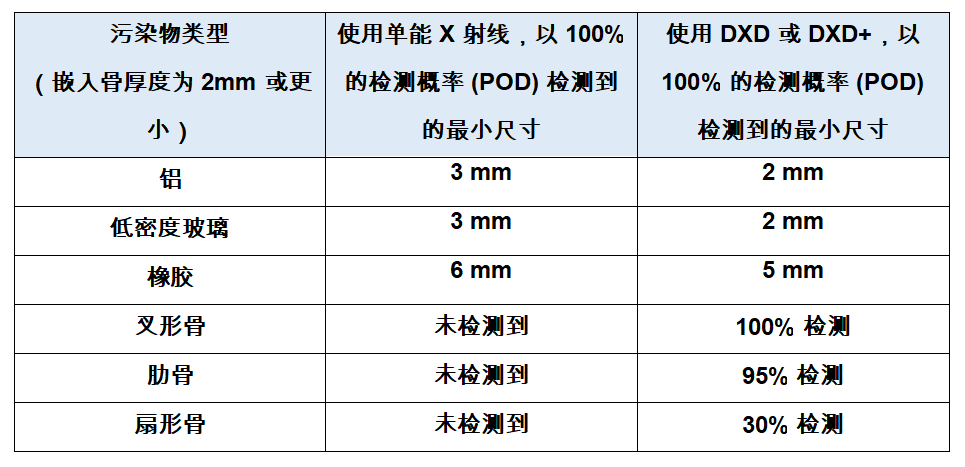 梅特勒托利多针对“难以发现”的污染物推出高品质X射线检
梅特勒托利多针对“难以发现”的污染物推出高品质X射线检
 探索婴幼儿辅食市场高质量发展之路,为宝宝成长保驾护航
探索婴幼儿辅食市场高质量发展之路,为宝宝成长保驾护航
 《食品安全最佳实践白皮书(2021-2022年)》四大主题发布
《食品安全最佳实践白皮书(2021-2022年)》四大主题发布
 《保健食品真实世界研究通则》团标技术审查与特食跨
《保健食品真实世界研究通则》团标技术审查与特食跨
 凝聚全球食饮智慧 SIAL西雅展国际化水平再创新高
凝聚全球食饮智慧 SIAL西雅展国际化水平再创新高
 精准把控 高质发展,第三届微生物安全与应用会议在
精准把控 高质发展,第三届微生物安全与应用会议在
 《食品行业科技创新白皮书》重磅发布!
《食品行业科技创新白皮书》重磅发布!






参与评论