姜黄素抗氧化的初步机理研究
摘要:姜黄素(curcumin, Cur)是一种多酚类食品添加剂,具有抗炎等生理功能。这可能与其抗氧化能力密切相关,但作用机制尚不明确。本研究通过对姜黄素作用细胞的检测,发现姜黄素提高细胞的总抗氧化能力,降低活性氧(reactive oxygen species,ROS)水平;同时抗氧化酶超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)的表达和活性均有上调。这些结果提示姜黄素可能通过对SOD和GPx的调节提高细胞的抗氧化能力,进而减少ROS造成的损伤。
关键词:活性氧(ROS);线粒体;抗氧化酶
姜黄起源于印度,是常用的香料及色素,是制作咖喱不可或缺的主要材料,有高达六千年的食用历史,且具有较强的保健功效[1]。姜黄素(curcumin, Cur)是姜黄的主要成分之一。它是一种多酚类化合物,也是植物界中很稀少的二酮类色素,为橙黄色结晶粉末,味稍苦,不溶于水[2],与脂类食物一同食用更易吸收利用。作为姜黄的主要功效成分,姜黄素已通过国家食品药品监督管理局、粮农组织以及世界卫生组织食品添加剂联合专家委员会的安全性及毒性检测[3]。姜黄素因其分子中含有多个双键,以及酚羟基和羰基等活性基团,在护胃、保肝、抗氧化、增强免疫力、减肥等多个保健功效方面都具有很好的作用[1]。在亚洲一些国家,传统的饮食习惯使人们摄入较少的饱和脂肪酸和含糖食物,而摄入含有丰富的化学防护物质的植物,如姜黄素的摄入量(约 100 mg /d)明显高于西方国家[4]。在印度等经常摄入姜黄素的国家,肝癌等高发癌症的发病率远低于美国[5]。但是,姜黄素的作用机理尚未十分明确,进一步的探究可以帮助指导姜黄素的膳食摄入。
现代医学研究发现人体众多病变的引发与活性氧(reactive oxygen species,ROS)的形成有关,ROS氧中的自由基可通过致癌基因的激活、抑癌基因的失活、活化致癌物等途径引发癌症[6]。因此,增强自由基捕获能力, 消除或减轻自由基所造成的氧化损伤, 是预防和阻断癌症发展的有效方法[7]。姜黄素的多种活性与其抗氧化作用相关[8]。本文通过检测姜黄素对HepG2细胞抗氧化能力的影响,探究其可能的调节机理,可能为姜黄素对ROS相关疾病的预防保健提供理论依据。
方法
细胞培养及姜黄素处理
HepG2细胞购自上海中国科学院细胞库,培养基为含10%胎牛血清及1%青霉素-链霉素溶液的DMEM高糖培养基(SH30022.01,Hyclone),培养在37℃,含 5%CO2的细胞培养箱中。姜黄素处理方法:姜黄素(C1386,Sigma)以二甲基亚砜(DMSO,Amresco)为溶剂,配制成27 mM的母液。将细胞以4×105/ mL的密度接种于六孔板中,过夜培养后加入姜黄素至终浓度5、10、15 μM,继续培养24小时。
细胞增殖率检测
将HepG2细胞以1×105/ mL的密度接种于96孔培养板,每孔100 μL。细胞贴壁后,加入姜黄素继续培养24小时,每孔加入20 μL浓度为 5mg/mL的四甲基噻唑蓝(MTT,奥多福尼),37℃孵育4 h后吸弃上清,加入150 μL DMSO以溶解生成的甲臜,继续震荡10分钟,用多功能酶标仪(SYNERGY/H1,Biotek)测定A490,以溶剂为对照计算细胞相对增殖率。
细胞相对增殖率=(OD实验组-OD本底)/(OD对照-OD本底)×100%
ROS水平检测
采用活性氧检测试剂盒(S0033,碧云天),按产品说明书进行操作。即细胞用姜黄素处理24 h后吸弃培养基,加入含10 μM DCFH-DA探针的工作液于37℃孵育30分钟,然后用Opti-MEM无血清培养基(31985-070,Gibco)清洗残余染料,最后将细胞收集重悬于无血清培养基中,用酶标仪检测荧光强度(EX488 nm,EM525 nm),并以样品的蛋白量进行标准化计算单位蛋白量下的ROS水平。
总抗氧化能力检测
分别选用碧云天的总抗氧化能力检测试剂盒S0119和S0116进行检测。即细胞用姜黄素处理后吸弃培养基,用预冷的磷酸盐缓冲液(PBS,Hyclone)清洗三遍,细胞收集后重悬于PBS并超声波破碎,4℃ 12000g离心5分钟后,收集上清夜用于检测。按照试剂盒说明书设置检测体系,用酶标仪检测吸光值,计算单位蛋白量下的总抗氧化能力。最后将对照设为1,计算相对总抗氧化能力。
抗氧化酶活性检测
分别采用南京建成生物工程研究所总超氧化物歧化酶(SOD)测定试剂盒(A001-3-2)和 谷胱甘肽过氧化物酶(GSH-PX)测定试剂盒(A005-1-2)、碧云天的过氧化氢酶(CAT)检测试剂盒(S0051)进行检测。SOD和GPx检测的细胞处理及蛋白样品提取同总抗氧化能力检测,CAT检测采用细胞裂解液(P0013,碧云天)裂解获得蛋白样品。按照试剂盒说明书设置检测体系,酶标仪检测吸光值,计算单位蛋白量下的抗氧化酶活性。最后将对照设为1,计算相对抗氧化酶活性。
基因表达水平检测
采用实时荧光定量PCR(qRT-PCR)法检测。按Trizol Reagent试剂盒(15596-018,Ambion)的说明提取细胞总RNA,并用M-MLV Reverse transcriptase试剂盒(M1705,Promega)将其反转录为cDNA,用TAKARA的SYBR Premix Ex Taq II试剂盒(RR820A)在Applied Biosystems的ABI7300实时荧光定量PCR仪中反应并测定,以GAPDH为内参。本文所用qRT-PCR引物序列如下:SOD2(GCTGCACCACAGCAAGCACC和CCAGCAACTCCCCTTTGGGT)、GPx-1(GTGCTCGGCTTCCCGTGCAAC和CTCGAAGAGCATGAAGTTGGGC)、CAT(GTGCGGAGATTCAACACTGCCA和CGGCAATGTTCTCACACAGACG)和GAPDH(ATGACATCAAGAAGGTGGTG和CATACCAGGAAATGAGCTTG)。目的基因的mRNA相对表达水平以2-∆∆ct公式进行计算。
统计学分析
数据表示为平均值±平均值的标准误差(SEM),用SPSS 19分析软件运用单因素方差分析(ANOVA)进行比较,测定数据均独立重复三次以上进行统计学分析,﹡P<0.05认为数据差异具有统计学意义。
结果
姜黄素对细胞增殖的影响
姜黄素对HepG2细胞增殖的影响如图1所示。作用24小时后,细胞增殖率随姜黄素浓度提高略有下降。此时细胞尚能有效调节代谢,因此选择5~15 μM为姜黄素作用浓度进行后续检测。

图1 姜黄素对HepG2细胞增殖率的影响
注:5、10、15 μM姜黄素处理HepG2细胞24小时后进行MTT检测,将对照(溶剂DMSO处理,即姜黄素浓度为0)的增殖率设为100%。计算细胞相对增殖率。统计分析:单因素方差分析(n≥3)。
姜黄素降低ROS水平
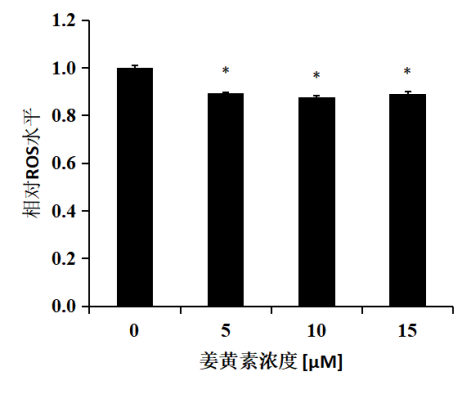
图2 姜黄素对HepG2细胞ROS水平的影响
确定姜黄素作用浓度后,检测姜黄素对细胞ROS的影响。结果如图2所示,与对照相比,姜黄素处理24小时后,细胞ROS含量显著下降(P<0.05),提示姜黄素能够显著抑制HepG2细胞中ROS的积累。
注:5、10、15 μM姜黄素处理HepG2细胞24小时后,姜黄素显著降低细胞ROS水平。结果表示为与对照(DMSO处理即姜黄素浓度为0)相比的DCFH-DA荧光强度,将对照的ROS水平设为1.0。统计分析:单因素方差分析(n≥3),﹡P<0.05。
姜黄素提高总抗氧化能力
进一步检测姜黄素对细胞总抗氧化的影响。采用ABTS、FRAP法用碧云天的检测试剂盒进行操作。结果显示,与对照相比,姜黄素处理后,细胞内总抗氧化能力显著提高(P<0.05)(图3),提示姜黄素能够显著提高细胞抗氧化能力。
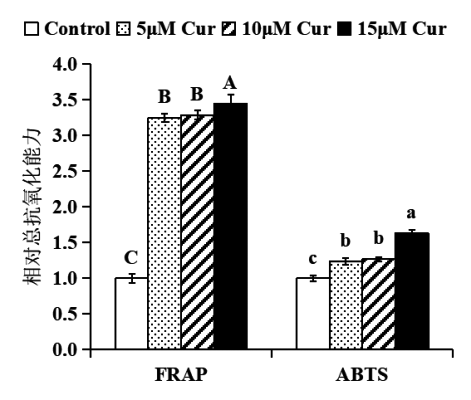
图3 姜黄素对HepG2细胞总抗氧化能力的影响
注:5、10、15 μM姜黄素处理HepG2细胞24小时后,姜黄素显著提高细胞总抗氧化能力。结果表示为姜黄素处理样品与对照(DMSO处理)相比的总抗氧化能力(FRAP法和ABTS法检测),将对照的总抗氧化能力设为1.0。统计分析:单因素方差分析(n≥3),不同字母的数值间有显着性差异P<0.05。
姜黄素对抗氧化酶活性及基因表达水平的影响
确定姜黄素提高HepG2细胞的抗氧化能力后,进一步探究其可能的机理。首先检测姜黄素对细胞抗氧化酶活性的影响,结果如图4所示。与对照相比,姜黄素处理样品的SOD及GPx酶活性显著提高(P<0.05),CAT酶活性变化不大,只在大浓度姜黄素处理时略有下降。这提示姜黄素能够提高抗氧化酶SOD和GPx的活性,而对CAT酶活性影响不大。
最后检测这三种抗氧化酶基因的表达水平。由于金属辅机不同,SOD分为Fe-SOD、Mn-SOD、Cu/ZnSOD等,其中定位于线粒体的Mn-SOD是清除ROS的主要类型。通过对Mn-SOD(SOD-2)、细胞中的GPx(GPx-1)和CAT的mRNA表达水平检测发现,与对照相比,姜黄素处理细胞中的SOD-2和GPx-1基因表达水平显著上调(P<0.05),而CAT基因表达水平无显著变化。
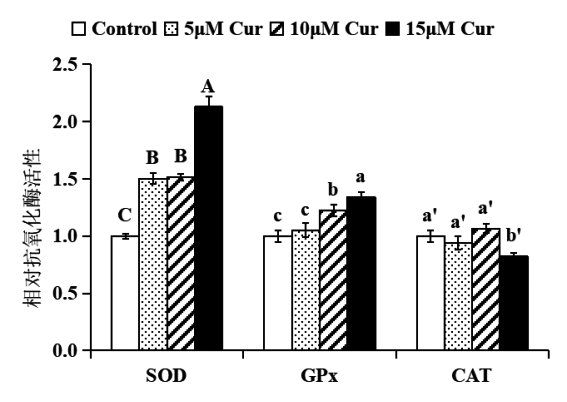
图4 姜黄素对HepG2细胞抗氧化酶活性的影响
注:5、10、15 μM姜黄素处理HepG2细胞24小时后,姜黄素显著提高SOD、GPx酶活性,而CAT酶活性变化不

图5 姜黄素对HepG2细胞抗氧化酶基因表达的影响
大,仅在大浓度姜黄素作用时略有下降。结果表示为姜黄素处理样品与对照(DMSO处理)相比的酶活性,将对照的酶活性设为1.0。统计分析:单因素方差分析(n≥3),不同字母的数值间有显着性差异P<0.05。
注:5、10、15 μM姜黄素处理HepG2细胞24小时后,SOD-2、GPx-1基因的mRNA水平显著上升,CAT基因表达无显著变化。结果表示为与对照(DMSO处理)相比的目的基因表达水平,以GAPDH为内参,将对照的基因表达水平设为1.0。统计分析:单因素方差分析(n≥3),不同字母的数值间有显着性差异P<0.05。
讨论
姜黄素是世界卫生组织准许使用的食品添加剂,其两侧苯环上的甲氧基能够增强其抗氧化活性[4]。姜黄素的自由基清除效果强于维生素E多倍,对类自由基的清除作用更强[9],因此它也被应用于膳食保健。但在姜黄素的体内抗氧化活性研究中,它对不同细胞和动物模型的作用效果和机理不尽相同,且可能通过多途径产生影响[11],因此相关机制还在不断探究中。
ROS中包含的自由基等强氧化物质会造成细胞氧化损伤(oxidative damage),而氧化损伤与多种慢性病如心血管病、癌症等密切相关[12]。在正常生理状态下, ROS维持在较低水平,微量的ROS参与细胞内多种生化反应[13, 14],而在癌细胞中ROS过量产生,通过诱导基因组不稳定性,修饰基因表达和参与信号传导等途径促进癌变发展[15]。近年来的研究发现,降低ROS产生量能够降低癌症发病率和病死率[16],抑制肿瘤细胞增殖和血管生成[17, 18]。因此,控制细胞中ROS的产生对预防癌症等机体损伤具有积极作用。本研究显示姜黄素作用24h显著降低HepG2细胞的ROS水平。这可能是姜黄素激活了细胞内源性的抗氧化防御机制,提高了抗氧化能力引起的。抗氧化酶和非酶抗氧化物质是细胞抗氧化活性的重要组成部分,抗氧化酶中SOD是首当其冲的的第一道抗氧化防线,能催化强自由基超氧阴离子O2•—歧化转化为过氧化氢,过氧化氢由GPx、CAT等抗氧化酶迅速分解生成水和氧气。本研究结果显示,姜黄素能够显著提高细胞的总抗氧化能力、SOD和GPx酶的活性,提示姜黄素降低ROS累积可能是由提高抗氧化酶活性、增强抗氧化功能引起的。这与曾瑜等的报道[19]类似, 他们发现急性酒精肝损伤小鼠的血清与肝组织SOD、GSH-Px活力会随姜黄素浓度增加而升高。
Mn-SOD特异性定位于线粒体,其作用在于维持氧自由基的平衡、清除转移超氧阴离子自由基、防御氧化损伤。本研究结果显示,姜黄素能够显著提高Mn-SOD、GPx-1的mRNA表达水平,与细胞中SOD和GPx等抗氧化酶活性增加的结果一致。抗氧化酶基因表达量的增加有助于酶活的提高,提示姜黄素可能通过对Mn-SOD和GPx-1基因的调节发挥其抗氧化作用,更详尽的机制还需进一步深入研究。CAT酶活性仅在高浓度姜黄素作用后略有下降,其基因表达量也无明显变化,提示在HepG2细胞中CAT的酶活性和表达可能与姜黄素的抗氧化作用无紧密关系。
综上,姜黄素可以增强HepG2细胞的SOD和GPx酶活性,提高细胞的总抗氧化能力,使细胞中ROS水平下降,Mn-SOD和GPx-1的基因表达上调。姜黄素的抗氧化作用可能是通过调节抗氧化酶的表达和活性实现的,但具体的机理仍有待研究。本研究阐述了姜黄素可能的抗氧化作用机制,可为姜黄素的膳食保健应用提供理论依据及方向引导,但更深入详细的细胞内姜黄素的生物学功能途径还有待进一步发掘。
参考文献
[1]杨长军,马云,李铁柱,崔群英.姜黄保健功效研究及市场前景分析[J].食品研究与开发,2016,37(06):218-220.
[2] 王涵东, 梁维邦, 姜黄素的研究进展. 江苏医药 2014, 40, 1193-1194.
[3] Authority, E. F. S., Scientific Opinion on the re-evaluation of curcumin (E 100) as a food additive. Efsa Journal 2010, 8, n/a-n/a.
[4] Stig Bengmark,刘青. 植物源保护剂姜黄素的研究进展[J]. 现代药物与临床, 2009, 24(01): 22-31.
[5] Choudhuri T , Pal S , Agwarwal M L , et al. Curcumin induces apoptosis in human breast cancer cells through p53-dependent Bax induction[J]. FEBS Letters, 2002, 512(1-3):0-340.
[6] José L Quiles, Mesa M D , César L RamírezTortosa, et al. Curcuma longa extract supplementation reduces oxidative stress and attenuates aortic fatty streak development in rabbits.[J]. Arteriosclerosis Thrombosis & Vascular Biology, 2003, 15(4):173-174.
[7] Trush M A, Kensler T W. An overview of the relationship between oxidative stress and chemical carcinogenesis[J]. Free Radical Biology & Medicine, 1991, 10(3-4):201
[8] 宫芸芸. 氧化损伤与癌症的发生和预防[J]. 国外医学(卫生学分册), 2000, (01): 11-14.
[9] 黄真真, 曾瑜, 贾贞超, 张立实, 姜黄素及其衍生物的抗氧化作用研究进展. 预防医学情报杂志 2016, 32, 1237-1240.
[10]SREEJAYAN, Rao M N A . Nitric Oxide Scavenging by Curcuminoids[J]. Journal of Pharmacy & Pharmacology, 2011, 49(1):105-107.
[11]李军,熊琨,龚元,于翔.基于信号转导通路的姜黄素抗氧化机制研究进展[J].中草药,2016,47(13):2373-2380.
[12] Dreher D, Junod A F. Role of oxygen free radicals in cancer development[J]. European Journal of Cancer, 1996, 32(1):0-38.
[13] Collins, A., Oxidative DNA damage, antioxidants, and cancer. BIOESSAYS 1999, 21, 238-246.
[14] Holdom, M. D., Lechenne, B., Hay, R. J., Hamilton, A. J., Monod, M., Production and characterization of recombinant Aspergillus fumigatus Cu,Zn superoxide dismutase and its recognition by immune human sera. J CLIN MICROBIOL 2000, 38, 558-562.
[15] Yang, Y., Karakhanova, S., Hartwig, W., D'Haese, J. G., et al., Mitochondria and Mitochondrial ROS in Cancer: Novel Targets for Anticancer Therapy. J CELL PHYSIOL 2016, 231, 2570-2581.
[16] Noto, H., Goto, A., Tsujimoto, T., Noda, M., Cancer risk in diabetic patients treated with metformin: a systematic review and meta-analysis. PLOS ONE 2012, 7, e33411.
[17] Sanchez-Sanchez, B., Gutierrez-Herrero, S., Lopez-Ruano, G., Prieto-Bermejo, R., et al., NADPH oxidases as therapeutic targets in chronic myelogenous leukemia. CLIN CANCER RES 2014, 20, 4014-4025.
[18] Harrison, I. P., Selemidis, S., Understanding the biology of reactive oxygen species and their link to cancer: NADPH oxidases as novel pharmacological targets. Clin Exp Pharmacol Physiol 2014, 41, 533-542.
[19] 曾瑜,刘婧,黄真真,潘兴昌,张立实.姜黄素对急性酒精性肝损伤小鼠抗氧化功能的影响[J].卫生研究,2014,43(02):282-285.
崔冬月 李媛媛 肖宝平 刘静雯 李健 苏文金 李桂玲
1.集美大学食品与生物工程学院,福建 厦门 361021;1
2.福建省海洋功能食品工程技术研究中心,福建 厦门 361021;
作者简介:崔冬月(1990-),女,汉族,河北任丘,集美大学,硕士,研究方向:食品营养与基因组学;
*通讯作者:李桂玲(1976-),女,汉族,副教授,集美大学,博士,研究方向:食品营养与基因组学。
基金项目:福建省自然科学基金项目(2017J01447);国家自然科学基金(31771972);海洋功能食品工程技术研究中心开放基金(C11167)

相关热词搜索:
[责任编辑:]

 Mettler-Toledo 在中国国际渔业博览会上展示创新的产品
Mettler-Toledo 在中国国际渔业博览会上展示创新的产品
 食品异物问题频发?是时候了解X射线检测了
食品异物问题频发?是时候了解X射线检测了
 开拓科技创新,撬动橡塑业高质量发展
开拓科技创新,撬动橡塑业高质量发展
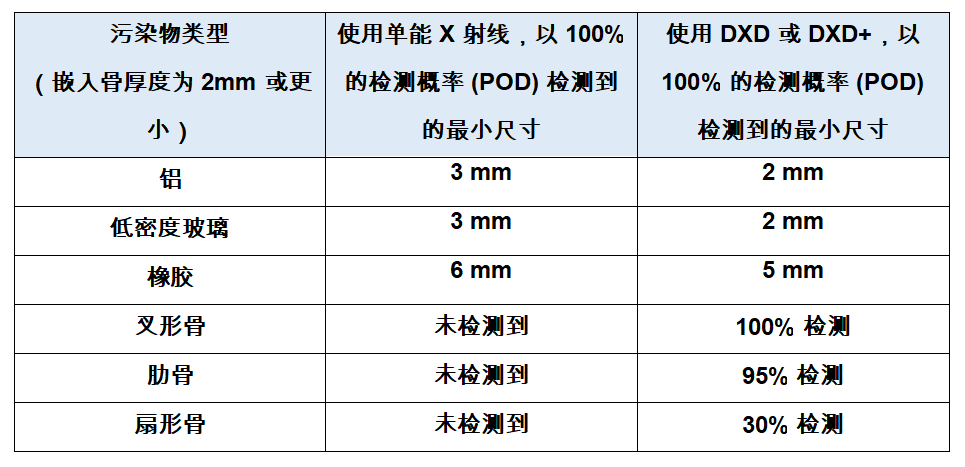 梅特勒托利多针对“难以发现”的污染物推出高品质X射线检
梅特勒托利多针对“难以发现”的污染物推出高品质X射线检
 探索婴幼儿辅食市场高质量发展之路,为宝宝成长保驾护航
探索婴幼儿辅食市场高质量发展之路,为宝宝成长保驾护航
 《食品安全最佳实践白皮书(2021-2022年)》四大主题发布
《食品安全最佳实践白皮书(2021-2022年)》四大主题发布
 《保健食品真实世界研究通则》团标技术审查与特食跨
《保健食品真实世界研究通则》团标技术审查与特食跨
 凝聚全球食饮智慧 SIAL西雅展国际化水平再创新高
凝聚全球食饮智慧 SIAL西雅展国际化水平再创新高
 精准把控 高质发展,第三届微生物安全与应用会议在
精准把控 高质发展,第三届微生物安全与应用会议在
 《食品行业科技创新白皮书》重磅发布!
《食品行业科技创新白皮书》重磅发布!






参与评论