副溶血弧菌检测方法的研究进展
副溶血弧菌检测方法的研究进展
贾 晨1,王 丹2、王 琪3、刘 磊1,曲连海1,周 琦1
(1.北京美正生物科技有限公司,北京 101100;2.龙大食品集团有限公司,山东莱西 266600;
3.郑州市食品药品检验所,河南郑州 450000)
摘 要∶ 木文介绍了副溶血弧菌的传统检测方法、免疫学检测方法和分子生物学检测方法等几种快速的检测方法,通过对多种检测方法的优缺点进行分析,为食品行业中副溶血弧菌的检测方法选择方面提供理论依据。
关键词∶ 副溶血弧菌;培养法;免疫学检测;分子生物学检测
副溶血弧菌(岡切V。parahaemolyticus, EP)是一种革兰氏 阴性嗜盐性弧菌叫 常在河口、海底沉积物等海洋环境中, 以及鱼贝类等海产品中检出较多[2]»副溶血弧菌不仅严重危 害海水养殖业,还能引发人类胃肠炎、食物中毒等,是一种 条件致病菌口。近年来,由于误食受副溶血弧菌污染或加工 不当的海产品而导致的食物中毒事件层出不穷,在我国部分 沿海地区,细菌性食物中毒位居首位折叫通过对副溶血弧 菌的快速检测,可以有效防止相关疾病的传播和发生。近年 来,对副溶血弧菌检测方法的研究取得了较大的进展,本文 主要通过对多种检测方法的优缺点进行分析,为检测方法的 选择提供理论基础。
1培养法
目前,传统的培养方法是国家标准对于副溶血弧菌的检 测回,根据检测需求,分为定性检测和定量检测。取样品 25 g置于3%氯化钠碱性蛋白踪水(APW)中,分别进行定 性的增菌和定量的梯度稀释后,接种到TCBS或弧菌显色培 养基中。挑取可疑菌落,进行生理生化鉴定,如氧化酶试验、 革兰氏染色镜检、三糖铁试验、嗜盐性试验、生化鉴定、血 清学试验、神奈川试验等,整体操作时间过长,涉及到的试 验方法以及试剂过多,易造成检测结果出错。
1.1显色培养基
显色培养基是近些年逐步应用在检测行业的传统培养基 代替品,它是一类由目标微生物的代谢产物中的酶,与特 异性的酶显色底物进行反应,显色酶底物与微生物代谢酶 相结合,显色基团游离进而显色的原理,检测目标微生物 的新型培养基。与传统的培养基相比,显色培养基具有较 高的灵敏度和特异性。OLIVIA等使用弧菌的显色培养基 和传统培养基对于河口不同季节的水样进行测定,通过对 菌株的测序,验证了传统培养基对创伤弧菌的假阳性率有 2%,霍乱弧菌的假阳性率为19%,而副溶血弧菌的假阳性 率达到59%。弧菌的显色可以显著降低假阳性率2〜5倍。 EDDABRA等回对96个粪便和拭子样本进行测试,通过显 色培养基和TCBS(硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养 基)对比发现,霍乱弧菌在显色培养基的检出率为34%,在 TCBS中的检出率为31%。对霍乱弧菌和副溶血弧菌的特异 性进行检测,显色培养基的特异性达到100%,而TCBS的 特异性只有93.33%。显色培养基的特异性明显高于TCBSo 1.2微生物测试片
微生物测试片是预制型的培养基,釆用快速扩散技术、 新一代微生物显色等创新技术,可实现菌落的快速增殖和判 读,提高实验室的检测效率。许如苏等?以副溶血弧菌、 霍乱弧菌、溶藻弧菌等49株标准菌对测试片的敏感性、特 异性和可重复性进行检测。结果表明,副溶血弧菌在测试片 上表现为紫色菌落,其他非目标微生物显示蓝色或者不生 长;重复性试验结果相对偏差偏低,检测结果良好。但是由 于需要考虑实际样本中的副溶血弧菌的检测以及样品的适 应性等多种因素干扰,有较高的难度。
2免疫学检测方法
免疫学检测方法主要有酶联免疫法吸附法、血清型法、 免疫荧光技术、免疫扩散技术、免疫胶体金技术和免疫印迹 技术等[10]o它们主要的原理是应用抗原和抗体的特异性进 行检测。但是免疫学检测方法对于抗体的特异性要求较高, 同时最低检出限偏高,导致漏检的可能性。
2.1免疫胶体金技术
免疫胶体金技术是釆用抗原抗体相结合的原理,以胶体 金作为标志物的一种免疫标记技术。朱慧等凹制备了兔抗 副溶血弧菌多克隆抗体,并对其效价进行测定,提取副溶 血弧菌的外膜蛋白、鞭毛蛋白、胞外产物和全菌破碎蛋白, 确定4种标记蛋白的浓度,以及抗原蛋白的特异性检测。检 测结果表明胶体金试纸条准确鉴定出副溶血弧菌,排除其他 非目标菌的交叉反应干扰,对人工感染的结果可以进行准确 判断。
2.2酶联免疫吸附法
酶联免疫吸附法简称ELISA,是酶联免疫中应用较广的 免疫测定技术。其原理是抗原或抗体固定在载体表面,在载 体表面发生抗原抗体反应,酶与底物发生显色反应,洗涤后, 可通过吸光值进行检测。ELISA方法可以进行定性或者定 量的分析。李国等凹从濒死的文蛤中分离鉴定出一株副溶 血弧菌,并用该菌苗制备兔抗血清,以HRP-羊抗兔IgG为 酶标二抗,对人工感染副溶血弧菌的样本进行ELISA检测。 结果显示,釆用间接ELISA技术检测副溶血弧菌,人工污 染的文蛤样本副溶血弧菌的检出率为80%,健康文蛤样本 的副溶血弧菌检出率为15%。结果表明ELISA检测法可以 用于发病文蛤的检测,但还是有假阴性存在。
3分子生物学检测方法
3.1 PCR方法
随着分子生物学的飞速发展,PCR的方法已经被逐渐的 写入标准中。PCR 方法(Polymerase chain reaction, PCR), 又称聚合酶链式反应,是一种通过温度控制可实现体外扩增 特异DNA片段的技术。PCR检测具有灵敏度高、特异性强 等优势。KIM等1131基于toxR基因的PCR方法检测副溶血 弧菌,釆用28个目标和非目标菌株建立了 PCR检测方法, 通过494株菌株检测目标菌株的特异性。结果75.5%的副 溶血弧菌较强的特异性,非目标菌株没有得到扩增。PCR 检测方法虽然灵敏度较高,但是过于依赖目标基因的分离和 富集,且易受到程序设置的干扰。
3.2实时荧光定量PCR技术
实时荧光定量PCR技术具有灵敏度高、重复性好、准 确性高等优点。王建昌等凹根据已知的副溶血弧菌基因组 序列,筛选特异性靶基因,设计特异性引物探针,优化反 应体系,并在体系内加入内参(必C),通过标记不同荧光 基团的Ihgman探针来监测IAC,进而实时监控整个PCR反 应。建立gyrB-IAC相关标准曲线,Ct值与拷贝数有良好的 线性关系;人工污染的初始菌量为7cfb/25g,样品增菌6 h 后,副溶血弧菌即可检出。胡兴娟等凹针对副溶血性弧菌 侃基因,沙门菌。冲c基因和单增李斯特菌基因设计引 物和&gMan探针,建立3种致病菌的多重荧光定量PCR 检测体系,并对海产品中的副溶血性弧菌、沙门菌和单增李 斯特菌的进行检测。结果3种目标致病菌均可得到特异性扩 增,而其他非目标细菌均未见特异性扩增曲线。该体系对副 溶血性弧菌、沙门氏菌和单增李斯特菌的最低检测限均小于 100 cfu/mLo并对150粉实际样本进行检测,与国家标准法 检出率一致。
3.3环介导等温扩增技术
环介导等温扩增技术(Loop-mediated isothermal amplification, LAMP)是一种新型的核酸扩增方法,其特 点是在链置换特异的DNA聚合酶(Bst DNA polymerase)的 作用下,设计4种特异引物,进行60 - 65 °C恒温扩增, 15〜60 min即可实现核酸扩增,具有操作简单、特异性强 等特点。反应过程中加入染料等,在DNA合成时,从脱氧 核糖核酸三磷酸底物(dNTPs)中析出产生大量焦磷酸镁沉 淀,呈现白色。因此,只需肉眼观察产物中的浊度即可,操 作过程简单,结果易判读。胡元庆等两用基因作为副溶 血弧菌的靶向基因,设计了 4条引物,优化LAMP检测方 法中的反应体系和反应条件。体系用BstDNA聚合酶催化, 恒温反应60 min,产物分别用2%琼脂糖凝胶电泳和SYBR Green I染色鉴定,对各项反应参数进行优化;将菌液的10 倍稀释液进行LAMP和PCR反应,并对32株食源性病原 菌进行LAMP扩增,验证其特异性;结果显示,确定25gL 体系中 Mg2+ 浓度为 3.6 mmol/L, dNTPs 浓度为 0.96 mmol/L, 聚合酶用量为4.8 U,内外引物浓度比为8 : 1,最佳反应 温度为63 P,时间为60 min; LAMP的最低检测限明显低 于PCR检出限;对32个菌株进行特异性检测,阳性率为 100%,说明LAMP具有较高的特异性。
3.4重组酶聚合酶等温扩增技术
重组酶聚合酶等温扩增技术(Recombinase Polymerase Amplification, RPA),是可以替代传统PCR的核酸检测技 术,是新一代的等温扩增核酸检测技术。RPA技术基于重 组酶聚合酶,且最佳反应温度在20 - 37 °C, 20 mm内完 成扩增反应。刘小青等"釆用RPA技术,建立了以,•滅 为靶基因的RPA-exo副溶血弧菌的引物探针,对引物探针 进行组合筛选,建立RPA-exo荧光探针快速检测方法, 15 min可完成检测,具有高特异性,无交叉反应,灵敏度较高 人工污染样品加入终浓度为1.36x103 CFU/mL时,无需增菌 即可被检出;实际样品检测检测结果与GB 4789.7-2013结 果一致。
4结语
副溶血弧菌的检测方法各有优缺点。传统国家标准检测 方法要经过培养基的基础培养,挑取可疑菌落分离、增菌、 镜检和生化鉴定等烦琐步骤;显色培养基和微生物测试片使 用方便,但需要具有特异性较高的酶底物。免疫学检测方法 对于抗体的特异性要求较高,同时最低检出限偏高,导致漏 检的可能性。分子生物学检测方法具有灵敏度高、重复性好、 反应髙效、准确性高等优势,但是过于依赖目标基因的分离 和富集,且容易受到程序设置的干扰。
食品中副溶血弧菌检测方法有传统检测方法、实时荧光 定量PCR、LAMP、RPA和MPCR-DHPLC法等,并可以 多种结合进行目标菌株鉴定。多种检测方法相结合,融合 多种优势,如LAMP技术与生物传感器技术相结合,酶联 免疫磁珠技术与PCR技术相结合,MALDI-TOF MS与16S rRNA鉴定相结合。基因芯片技术融合了 PCR、纳米芯片和 探针杂交。
上述针对副溶血弧菌的相关检测方法,无论是从科学调 査角度还是食品安全角度来说,对副溶血弧菌的有效检测都 存在着重要的研究意义。这些方法存在着一些不可忽视的问 题,应当综合考虑各检测方法优劣势,在多项技术的基础上 建立可以满足多方面需求的快速、高效、经济的检测方法, 才能实现副溶血弧菌的有效检测,保障食品安全。
参考文献
[1]金培婕,吴蒂禧,王淑娜,等.浙江沿海地区海产品及 环境中副溶血弧菌的分离与主要毒力基因分析[J].微生物学通 报,2009,36(7):962-967.
[2]WANG L,SHI L,SU J,et al.Detection of Vibrio parahaemolyticus in food samples using in situ loop - mediated isothermal amplification method[J].Gene,2013,515(2):421-425.
[3]MCPHERSON V L,WATTS J A.SIMPSON L M,et al. Physiological effects of the lipopolysaccharide of Vibrio parahaemolyticus on mice and rats[J] .Microbios, 1991,67:272-273.
[4]刘秋爽.副溶血弧菌引起食物中毒调查[J].医疗装 备,2018,31(1):71-72.
[5]庞璐,张哲,徐进,等.2006-2010年我国食源性疾病暴 发简介[J].中国食品卫生杂志,201123(6):560-563.
[6]国家卫生和计划生育委员会.食品安全国家标准食品 微生物学检验副溶血性弧菌检验:GB/T4789.7—2013[S],北京: 中国标准化出版社,2013.
[7]OLIVIA D N,GRIEG F S .Differential specificity of selective culture media for enumeration of pathogenic vibrios: Advantages and limitations of multi-plating methods[ J] Journal of Microbiological Methods, 2015(111):24-30.
[8]EDDABRA R, PIEMONT Y.SCHEFTEL J M.Evaluation of a new chromogenic medium, chromID ™ Vbrio, for the isolation and presumptive identification of Vibrio cholerae and Vibrio parahaemolyticus from human clinical specimens[J] .European Journal of Clinical Microbiology, 2011,30(6):733-737.
[9]许如苏,林彩华,黄桂荣,等.副溶血性弧菌快速测试 片检测性能研究[J],中国卫生检验杂志2008(18):2621-2623.
[10]殷蓄琦,黄秋芳,三种不同免疫检测法对乙肝血 清学标志物检测的结果对比分析[J].标记免疫分析与临 床,2017^4(6):682-685.
[11]朱慧,李嘉文,绳秀珍,等.副溶血弧菌胶体金快 速检测试纸的研制及应用[J],中国海洋大学学报(自然科学 版).2021,51(3):24-33.
[12]李国,闫茂仓,常维山,等.文蛤副溶血弧菌间接 ELISA检测技术的研究[J],海洋通报2008(5):85-90.
[13]KIM Y B,OKUDA J,MATSUMOTO C,et al.Identification of Vibrio parahaemolyticus strains at the species level by PCR targeted to the toxR gene[J].Journal of Clinical Microbiolo gy,1999,37(4):1173-1177.
[14]王建昌,王金凤,李静,等.基于内参的副溶血性弧菌 实时荧光定量PCR快速检测方法的建立[J],中国食品卫生杂 志,201527(4):408413.
[15]胡兴娟,沈飕,余辉,等.多重荧光定量PCR法检测 海产品中副溶血性弧菌、沙门氏菌和单增李斯特菌[J].中国食 品卫生杂志,2016,28(4):440-444.
[16]胡元庆,黄玉萍,李凤霞,等.水产品中副溶血性弧菌 LAMP检测方法的优化[J],现代食品科技,2017,33(6):313-320.
[17]刘小青,严琼英,陈国培,等.RPA等温扩增技术检测 副溶血性弧菌[J].食品工业科技,2020,41®:112-118.

相关热词搜索:
[责任编辑:]

 Mettler-Toledo 在中国国际渔业博览会上展示创新的产品
Mettler-Toledo 在中国国际渔业博览会上展示创新的产品
 食品异物问题频发?是时候了解X射线检测了
食品异物问题频发?是时候了解X射线检测了
 开拓科技创新,撬动橡塑业高质量发展
开拓科技创新,撬动橡塑业高质量发展
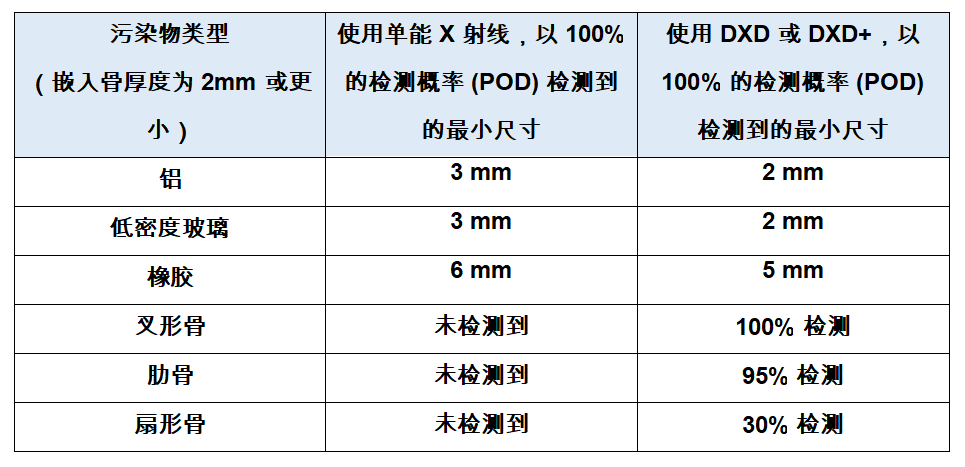 梅特勒托利多针对“难以发现”的污染物推出高品质X射线检
梅特勒托利多针对“难以发现”的污染物推出高品质X射线检
 探索婴幼儿辅食市场高质量发展之路,为宝宝成长保驾护航
探索婴幼儿辅食市场高质量发展之路,为宝宝成长保驾护航
 《食品安全最佳实践白皮书(2021-2022年)》四大主题发布
《食品安全最佳实践白皮书(2021-2022年)》四大主题发布
 《保健食品真实世界研究通则》团标技术审查与特食跨
《保健食品真实世界研究通则》团标技术审查与特食跨
 凝聚全球食饮智慧 SIAL西雅展国际化水平再创新高
凝聚全球食饮智慧 SIAL西雅展国际化水平再创新高
 精准把控 高质发展,第三届微生物安全与应用会议在
精准把控 高质发展,第三届微生物安全与应用会议在
 《食品行业科技创新白皮书》重磅发布!
《食品行业科技创新白皮书》重磅发布!






参与评论